
国家药监局评审中心在《中国食品药品监管》上最新发文,探索我国先进治疗药品的范围和分类。细胞产品有望划入先进治疗药品行列!
以细胞和基因治疗产品为代表的先进治疗药品(advanced therapy medicinal product,ATMP), 为癌症、遗传病、罕见病等疑难疾病的治疗带来了新的契机和选择。
根据Citeline数据库统计,截至2024年4月,全球共有100余种基因、细胞与RNA 产品获得批准上市,超过3700余种产品(其中包括约55% 的基因治疗产品,53% 的细胞治疗产品)处于临床前或临床(约占30%)开发阶段。
虽然我国先进治疗产业起步较晚,但目前已发展成为全球细胞疗法研发热度最高的地区。根据ClinicalTrials.gov 网站不完全统计数据,我国细胞治疗临床试验数量及申报产品数量位居全球第二位,仅次于美国。
自2021年我国第一个嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)治疗药品获批上市以来,我国上市CAR-T产品数量已占全球同类产品50%以上,我国先进治疗产业的发展已迈入与国际先进水平“并跑”的新阶段。
全球诸多国家和地区不断致力于强化ATMP 的监管体系顶层设计和监管能力建设。美国食品药品监督管理局(Food and Drug Administration,FDA)、欧洲药品管理局(European Medicines Agency,EMA)、日本药品医疗器械综合机构(Pharmaceutical and Medical Device Agency,PMDA)等药品监管机构逐步建立了ATMP 的监管框架,积极制定发布相关法规及指南,并不断完善。据不完全统计,全球各监管机构迄今已发布400 余个细胞与基因治疗产品相关的技术指南。部分国家和地区在法律法规层面明确了这类药品的定义及分类,并制定激励政策(如特殊审评程序等)加速产品审批上市。
作者认为分类与产业发展紧密相关,明确ATMP在我国的分类及定义迫在眉睫。
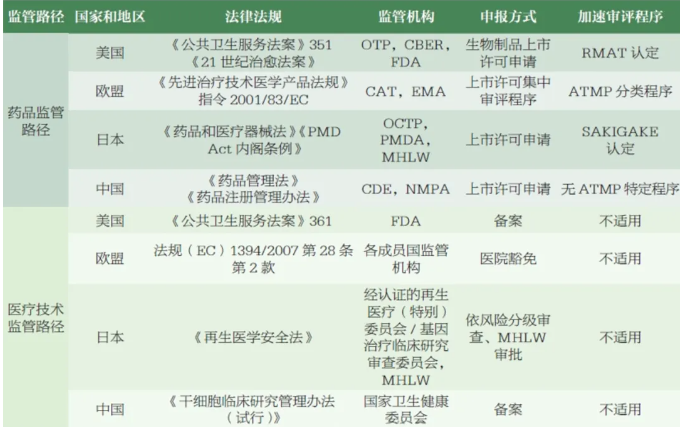
为确保ATMP的安全性和有效性,全球多个国家和地区都在加强监管体系的建设。美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、日本药品医疗器械综合机构(PMDA)等已建立了完善的ATMP监管框架,并发布了大量技术指南。这些措施不仅规范了ATMP的研发和审批流程,也为产品的市场推广提供了有力支持。
中国国家药品监督管理局(National Medical Products Administration,NMPA)目前已发布这类产品相关技术指导原则30余个,覆盖研发、注册、工业化生产、上市后变更等各个阶段。在我国,该类产品适用于鼓励创新、加速审评审批等多种程序,但目前尚未在法律法规层面明确该类药品的分类与定义,其名称和分类尚未形成行业共识,名称使用及分类的不统一,不利于规范监管、行业沟通及国际协调。
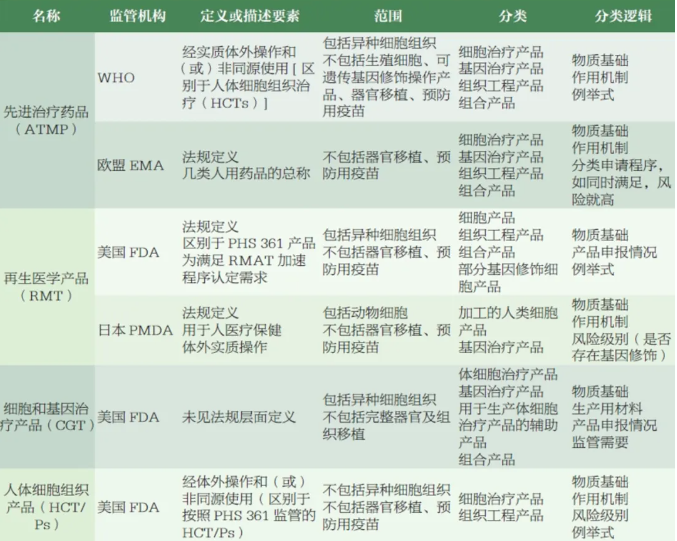
结合国外监管机构ATMP 监管分类的调研情况,CDE 组织相关部门梳理了国内相关产品的申报情况,初步提出了我国ATMP 的分类和描述,召开了专家研讨会,邀请学术界、工业界和监管领域的专家围绕名称拟定、分类和描述考虑要点开展了讨论,形成了以下建议。
(一)名称和描述
参考FDA、EMA、PMDA及WHO 等监管机构命名,结合国内现阶段工业界所用术语,该类产品的名称拟定时应主要考虑与国际接轨,同时体现产品的创新性和技术先进性,从而鼓励国内相关行业发展,并前瞻性地为未来新兴技术药品预留监管空间,可参考WHO 和EMA 将总的名称与具体分类结合考虑,确保总的名称突出药品属性,覆盖绝大多数相关药品种类,同时做好细化分类的归属。考虑到“细胞和基因治疗产品”主要体现产品物质基础,“再生医学产品”主要体现产品功能,相对局限,“先进治疗药品”的覆盖范围相对较广,并与WHO 等国际监管机构协调一致,建议采用“先进治疗药品”作为这类产品的中文名称,英文名称为“ATMP”。
参考国际监管机构对该类产品的释义,结合专家意见,笔者认为“先进治疗药品”的描述中应考虑纳入物质基础、工艺特点、功能用途等,同时基于体外操作程度和使用情形等对医疗技术相关边界产品的分类进行界定。考虑到该类产品按照药品监管,笔者将“体外操作”和“功能用途”作为ATMP 的描述要素, 并根据我国相关产品申报现状和未来发展趋势,基于活性成分的多样性及创新性完善相关描述。即描述为:“先进治疗药品是指经体外操作生产并在体内发挥作用的细胞治疗药品、基因治疗药品或组织工程药品,以及采用其他先进技术/ 方法生产的创新型药品等。”ATMP 的生产和研究过程需符合我国伦理方面的要求。输血用的血液成分、移植用的造血干细胞等不属于ATMP 的范畴。
物质基础方面,可考虑纳入目前国内申报量较大的产品类型如细胞治疗产品、基因治疗产品,同时纳入组织工程产品和其他新兴技术产品, 为新技术预留接口。工艺特点方面,结合FDA、EMA、WHO 等相关定义,通过体外简单操作制备且同源使用的细胞组织治疗产品不属于ATMP。因此笔者参考国际监管实践,结合产品生产常见工艺步骤,对描述中的“体外操作”明确了简单的释义,主要包括分离、纯化、扩增、基因修饰、基因编辑等。后续如有需要,将参考FDA 和其他监管机构的做法,进一步明确“体外操作”“同源使用”等定义。功能用途方面,参考国内生物制品监管现状,考虑到目前申报的产品主要为治疗用生物制品,因此描述中仅明确为治疗药品,暂不涉及预防、诊断相关用途。
结合专家建议,笔者对于医疗技术、涉及使用生殖细胞的产品等边界产品进一步开展了分类与界定。对于医疗技术,描述中考虑明确排除归属国家卫生健康委员会管理的输血、器官/ 组织移植等医疗技术。需要说明的是,这里的移植是指医疗机构的治疗手段,而非给药途径。例如,移植给药的基因修饰造血干细胞,由于其体外进行了复杂生产操作,因此也属于ATMP 范畴。对于涉及使用生殖细胞的产品和一些可遗传的基因修饰操作,由于来源和操作有多种不同情形,因此描述中明确了需满足我国伦理方面的要求。
(二)分类建议
为提升监管的科学性和有效性,鼓励药品研发不断创新,结合国际分类情况、产品物质基础、监管风险级别和国内产品研发申报现状, 笔者初步开展了ATMP 的分类研究, 并针对类别划分合理性和相关产品归属等进行了讨论。
1. 类别划分
研发申报方面,现阶段CDE受理审评的ATMP 种类和数量逐年增多,2023年ATMP临床试验的申报量达到生物制品总临床试验申报量的13%。截至2024年3 月,NMPA 批准了5个CAR-T 细胞治疗药品、2 个基因治疗药品上市。获得默示许可开展临床试验的产品中,活性成分主要包括免疫细胞、干细胞等细胞产品,腺相关病毒、腺病毒等携带转基因的病毒载体产品,具有选择性增殖和溶瘤活性的溶瘤病毒产品等。近年来,个性化肿瘤新生抗原产品的数量开始增长。另外,还有个别组织工程产品、组合产品申报。
结合研发申报现状、国内外监管法规/ 指南制定情况,为提升审评审批和监管效率,建议将我国ATMP 分为细胞治疗药品和基因治疗药品,对于难以分入这两类的药品,可考虑暂时单独设置一个类别“其他”,待认知成熟后再独立成为一类或进一步细分。例如,对于EMA、WHO 分类中的组织工程产品与组合产品,我国目前研发申报数量较少,现阶段建议归入其他类。具体类别的排放顺序方面, 可参考国际监管机构对该类药品按照产品研发成熟度由高至低、风险等级由低至高的排列顺序, 因此进行如下排列。
第一类:细胞治疗药品。
第二类:基因治疗药品。
第三类:其他。
2. 细胞治疗药品描述、亚类
不同细胞治疗药品在细胞来源、类型以及产品的复杂性方面各有差异。例如,细胞可以是自我更新的干细胞、分化方向确定的祖细胞或发挥特定生理功能的终末分化的细胞。细胞可以来源于自体,也可以来源于同种异体或异种。此外,细胞也可能是经过基因修饰的。这些细胞可以单独使用,也可以与生物大分子、化学小分子或结构材料联合使用。作用机制方面,干细胞治疗药品可通过补充或替换患者的受损细胞发挥组织重建作用,CAR-T 等免疫细胞可通过特异性杀伤肿瘤细胞发挥其生物学作用。结合国际监管机构对细胞治疗药品的描述,细胞治疗药品亚类的划分,总体需要考虑物质基础(活性成分)、作用机制和功能用途,即建议划分为非基因修饰细胞治疗药品和基因修饰细胞治疗药品。
笔者结合国际监管机构对细胞治疗产品的释义, 考虑其药理、免疫、代谢调节和细胞替换组织重建两大功能进行了描述,明确其以治疗疾病为目的,并列举了具体亚类及常见例子。目前WHO 的释义中,细胞治疗药品的物质基础需为有核细胞,但考虑到目前我国已有正在开展临床试验的红细胞类、血小板类药品,因此不建议限制有核细胞。
基于物质基础,以细胞作为主要活性成分的药品,根据细胞治疗产品是否经基因修饰,科学层面可将其分为非基因修饰细胞产品和体外基因修饰细胞产品两个亚类。考虑到CAR-T 等基因修饰细胞一般通过CAR 基因表达结合靶细胞从而发挥主要肿瘤细胞杀伤作用,FDA、EMA、WHO 等监管机构一般将基因修饰细胞纳入基因治疗产品的范畴。专家讨论认为,细胞治疗产品未来发展需要做大量修饰(包括遗传修饰、生物材料的联合使用等),但其物质基础及特征与细胞类似,最终起作用的药物形式为细胞,国内行业传统称之为细胞治疗产品。因此虽然这类产品归类到细胞治疗产品与部分国际监管机构分类不同,但是结合我国细胞产品行业分类现状,为了便于我国监管机构管理,建议将基因修饰细胞纳入细胞治疗药品范畴。
对于诱导多能干细胞(induced pluripotent stem cell, iPSC)衍生细胞产品是否属于基因修饰细胞,需要基于终产品是否有符合基因修饰定义的操作来确定。专家讨论认为,仅限于重编程生产iPSC 种子细胞的基因操作不是基因修饰,如不涉及后续细胞药品的基因修饰,则属于非基因修饰细胞产品。
3. 基因治疗药品描述、亚类
早期的基因治疗药品主要通过引入功能性蛋白转基因序列发挥作用, 常见使用病毒载体和质粒DNA 载体。近年来较新的基因修饰工具层出不穷,包括microRNA 等直接作用的核酸序列、通过短发夹状RNA(shRNA)起作用的RNA 干扰(RNAi)、锌指核酸酶(ZFN)或转录激活因子样效应因子核酸酶(TALEN)、分子剪刀和CRISPR-Cas 等基因编辑方法。这些工具可能通过基因沉默、外显子跳跃、基因调节、基因敲低和核苷酸改变介导基因序列的修复、扩增或删除。最近全球范围内,一些携带转基因的细菌载体产品逐步开始临床前研发或临床试验,相关细菌来自乳球菌属、李斯特菌属和链球菌属等,进一步扩充了基因治疗药品的类型。
国际监管机构对基因治疗药品的描述中,例举了其活性成分,阐述了其作用机制和功能用途。其中WHO 和EMA 均明确, 基因治疗产品的治疗效果与其所包含的重组核酸序列或该序列的基因表达产物直接相关。笔者结合国际监管机构描述,建议在基因治疗产品的描述中强调特异性改变基因序列/表达、引入外源基因等相关作用机制,并例举常见的活性成分。结合目前国内研发申报的基因治疗产品类型,基于活性成分可将基因治疗产品进一步细分为:病毒载体类药品、核酸类药品(DNA、RNA 等)、基因编辑类药品(如CRISPR-Cas9等)、溶瘤微生物或其他新型微生物类产品。
2005 年,我国批准了经基因改造的溶瘤腺病毒产品H101 上市。溶瘤病毒通常能够特异性地在肿瘤细胞中复制、增殖,通过直接裂解或激活机体免疫反应杀伤肿瘤细胞[39]。目前在我国也有溶瘤细菌等产品正在开展临床试验,考虑到尽可能覆盖更广泛的产品种类,笔者采用“溶瘤微生物”统一描述包括溶瘤病毒、溶瘤细菌在内的产品。作用机制方面,非基因改造的溶瘤微生物类药品与传统意义上通过基因改造发挥作用的基因治疗药品不同。但如将其单独自成一类,其研发申报数量预计远少于细胞治疗药品。专家讨论认为,根据溶瘤病毒产品近年来的研究申报情况以及其发展趋势,溶瘤微生物类药品基本均需要进行基因修饰或操作,对于非基因修饰的溶瘤微生物产品,考虑到其药学、非临床和临床研究与基因治疗药品相似,且WHO 文件已明确将其纳入基因治疗产品中,为促进国际监管趋同,也考虑纳入基因治疗药品类别。近年来科学家开始探索一些新型微生物的临床疗效,例如噬菌体产品等。为了区分该类产品与肠道益生菌等微生物类药品,笔者采用“其他新型微生物”来表述这类产品。
4. 其他类ATMP
根据我国创新生物制品申报现状,目前存在一些产品申报量小、总体研发成熟度相对低,但考虑到新技术发展趋势预期今后可能形成一类,例如肿瘤新生抗原产品、细胞衍生物(如外泌体)等。因此笔者设置“其他”类将这些产品纳入ATMP 的范畴,从而鼓励创新型产品的研发申报。由于这一类产品创新性强,难以拟定适宜的文字描述,笔者通过例举亚类来表述。这类产品主要包括新型递送系统药品(如细胞载体)、个性化靶点生物治疗药品(如肿瘤新生抗原药品)、细胞衍生物药品(如外泌体)、具有药品属性的组织工程药品(如人工器官或组织)等。
考虑到基因治疗产品中已经包括基因递送工具相关产品,但还有很多递送系统将蛋白、小分子等递送进入细胞,笔者将这类除了递送基因以外的递送工具纳入,包括递送蛋白的脂质纳米粒、递送小分子的囊泡类结构载体等。细胞衍生物中的外泌体既可以作为载药工具,也可以作为活性成分,其可能包裹蛋白或基因。基于物质基础可将其进一步细分为天然外泌体药物、基因工程化外泌体药物、外泌体载药药品(小分子)。一些病毒、细菌等囊泡结构药物也可以由细胞分泌生产,如病毒样颗粒,这类产品目前申报较少,后续出现时可通过具体问题具体分析,考虑是否可以纳入细胞衍生物亚类。另外,目前大量申报的产品中有一类个性化肿瘤新生抗原产品,这类产品的活性成分可能包括基因修饰的细胞、DNA、RNA 甚至多肽。基于物质基础难以将这类产品纳入细胞或基因治疗药品,因此考虑放置于其他类。
现阶段细胞治疗药品主要以单一细胞类型为主要活性成分研发,逐渐有组合多种细胞类型的产品用于临床试验。我国已有肝脏类器官等产品已开始用于临床研究,脑、胃肠、胰腺类器官和人工角膜等一些组织工程产品也在迅速发展过程中。结合研发现状,笔者考虑将具有药品属性的人工组织、器官类药品纳入其他类。对于异种移植产品,国内尚未出现此类药品申报,专家建议目前暂不考虑纳入异种移植。结合国际发展现状,如果后续国内出现遗传修饰的动物组织或者器官产品申报,考虑到该类产品涉及动物检疫和公共卫生方面人畜共患病的防控,可能需要与其他监管机构联合监管。
总结
ATMP 是当前生物医药领域最具潜力和前景的发展方向,占据国际竞争、国家战略规划的重要板块。临床价值引领、全产业链政策支持、前沿技术创新驱动、不断的资本加持及科学严格审慎的监管护航,将共同推动我国先进治疗产业的高质量发展,培育生物医药的新质生产力,及时满足人民群众未被满足的临床需求。